Cuprins
- 1. Istoric.1
- 2. Date generale.1
- 2.1 Proprietăţi.1
- 2.2 Utilizare.2
- 2.3 Sinteză.3
- 2.4 Structură.3
- 2.5 Reacţia de descompunere.3
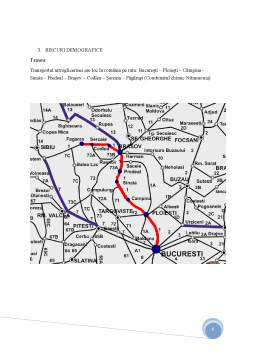
- 3. Riscuri demografice.4
- 3.1 Zone sensibile ale traseului.5
- 4. Scenarii de risc.5
- 5. Estimarea probabilităţii riscurilor majore pentru transportul de nitroglicerină.7
- 6. Arborele de avarie.12
- 7. Bibliografie.13
Extras din proiect
1. ISTORIC
Nitroglicerina a fost obţinută pentru prima dată în anul 1847 de către medicul şi chimistul Ascanio Sobrero din Torino. El a numit-o piroglicerină şi s-a speriat de potenţialul de distrugere a substanţei. O cantitate mică de nitroglicerină i-a distrus eprubeta. În 1867 chimistul suedez Alfred Nobel reuşeşte să producă dinamita, amestecând nitroglicerină cu kieselgur, un pămînt poros din schelete de diatomee (specie de algemicroscopice). Cel mai puternic exploziv „clasic” a fost produs din nitroglicerină şi nitrat de celuloză, în anul 1875, şi a fost folosit la săparea tunelului Gotthard Elveţia, într-o rocă foarte dură. Nitroglicerina stă la baza explozivilor clasici de azi, înlocuind praful de puşcă.
2. DATE GENERALE
Nume: Nitroglicerină
Alte denumiri: trinitroglicerină
trinitrat de glicerina
‘explozivul uleios al lui Nobel’
Formula chimică: C3H5O9N3
Nr. CAS: 55-63-0
Aspect: lichid incolor, inodor, uleios, dulceag.
2.1 PROPRIETĂŢI
În condiţii normale de temperatură şi presiune, nitroglicerina este un lichid incolor şi inodor cu o solubilitate redusă în apă, având un gust dulceag, care administrat chiar în doze relativ mici provoacă dureri de cap. Punctul de topire variază între 2,8°C şi 13,5°C în funcţie de izomer. Datorită prezenţei grupelor nitro- în molecula sa, este o substanţă relativ instabilă, care reacţionează violent la un aport relativ mic de energie, având o reacţie puternic exotermă. Nitroglicerina explodează deja la energia de ciocnire a unui ciocan de 2 kg care cade de la 10 – 12 cm înălţime, lichidul devenind într-un timp scurt gaz, ceea ce duce la o creştere rapidă a volumului.
Explosiv - Toxic - Dăunător mediului
Tabel: proprietaţi fizice.
Masa molară 227,09 g/mol
Stare de agregare Lichid
Densitate 1,5931 g•cm-3
Punct de topire 2,8°C -13,5 °C
Punct de fierbere 160 °C (20 hPa)
Presiunea gazelor 3,5•10-4 mbar la 20°C
Solubilitate Slabă în apă, bună îin acetonă, methanol, dietil de eter
Sensibilitate la lovire 0,2 Nm (0,02 kpm)
Sensibilitate la frecare până la 36 kp nici o reacţie
Viteza de detonaţie 6700-8500 m/s
Bombardarea recipientului de experienţă 520 ml/10 g
2.2 UTILIZARE
Exploziv: Nitroglicerina este un element important în fabricarea explozivilor, însă datorită sensibilităţii deosebite la acţiuni mecanice, manipularea ei trebuie făcută cu foarte mare atenţie. Chimistul suedez Alfred Nobel înlătură acest dezavantaj prin transformarea nitroglicerinei în dinamită. Aceasta explodează numai sub influenţa unei capsule de fulminat de mercur, iar procentul de 25% kieselgur inactiv reduce capacitatea de explozie a nitroglicerinei. În anul 1875, Nobel amestecă nitratul de celuloză cu nitroglicerina, elaborând astfel gelatina explozivă. Ulterior nitroglicerina va fi înlocuită de nitroglicol, acesta având punctul de îngheţ mai scăzut, de -22°C. Datorită punctului de fierbere mai scăzut, nitroglicolul nu este însă utilizat în ţările calde. Nitroglicerina este în prezent folosită în cantităţi mici la mărirea puterii substanţelor explozive pe bază de salpetru.
Medicină: Prin acţiunea sa vasodilatatoare este folosit la tratarea crizelor de Angor Pectoris, insuficienţă cardiacă şi în cazurile acute de infarct cardiac, prin administrare sublinguală. Încă din timpul lui Nobel, nitroglicerina era utlizată sub formă de soluţii alcoolice de diferite concentraţii, Nobel refuzând însă să fie tratat cu acest medicament.
2.3 SINTEZĂ
Nitroglicerina se obţine prin esterificarea glicerinei cu acid azotic concentrat, în prezenţa acidului sulfuric concentrat. Reacţia are loc prin introducerea amestecului de acizi în glicerina răcită, procedându-se astfel deoarece, reacţia fiind puternic exotermă, glicerina poate exploda sub însăşi infuenţa energiei termice dezvoltate în cursul reacţiei. si adaugarea de HCL.
Preview document
Conținut arhivă zip
- Managementul Riscurilor - Nitroglicerina.doc